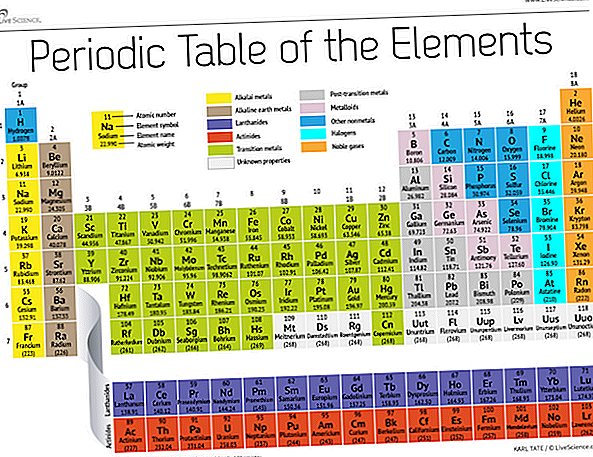
Konec 19. stoletja je ruski kemik Dmitri Mendeleev objavil svoj prvi poskus združevanja kemičnih elementov glede na njihovo atomsko maso. Takrat je bilo znanih le približno 60 elementov, vendar je Mendelejev spoznal, da se nekatere vrste elementov pojavljajo v rednih intervalih ali obdobjih, ko so bile težave organizirane po teži.
Danes, 150 let kasneje, kemiki uradno prepoznajo 118 elementov (po dodajanju štirih novincev leta 2016) in še vedno uporabljajo Mendelejevo periodično tabelo elementov, da jih organizirajo. Tabela se začne z najpreprostejšim atomom, vodikom, nato pa preostale elemente razvrsti po atomskem številu, kar je število protonov, ki jih vsak vsebuje. Z nekaj izjemami vrstni red elementov ustreza naraščajoči masi vsakega atoma.
Tabela ima sedem vrstic in 18 stolpcev. Vsaka vrstica predstavlja eno obdobje; številka obdobja elementa kaže, koliko njegovih energijskih nivojev je lastnih elektronov. Natrij na primer sedi v tretjem obdobju, kar pomeni, da ima natrijev atom ponavadi v prvih treh energijskih nivojih elektrone. Če se premikate po mizi, so obdobja daljša, saj za zapolnitev večjih in bolj zapletenih zunanjih nivojev potrebuje več elektronov.
Stolpci tabele predstavljajo skupine ali družine elementov. Elementi v skupini pogosto izgledajo in se obnašajo podobno, saj imajo v svoji najbolj oddaljeni lupini enako število elektronov - obraz, ki ga kažejo svetu. Elementi skupine 18, na primer na skrajni desni strani mize, imajo popolnoma polne zunanje lupine in redko sodelujejo v kemičnih reakcijah.
Elementi so običajno razvrščeni kot kovinski ali nemetalni, vendar je ločnica med njima mehka. Kovinski elementi so ponavadi dobri prevodniki električne energije in toplote. Podskupine znotraj kovin temeljijo na podobnih lastnostih in kemijskih lastnostih teh zbirk. Naš opis periodične tabele uporablja splošno sprejete skupine elementov, navaja Nacionalni laboratorij Los Alamos.
Alkalne kovine: Alkalijske kovine predstavljajo večino skupine 1, prvega stolpca tabele. Te kovine so tako svetleče in dovolj mehke, da se režejo z nožem in začnejo z litijem (Li) in končajo s francijem (Fr). Prav tako so izjemno reaktivni in ob stiku z vodo v plamenu eksplodirajo ali celo eksplodirajo, zato jih kemiki hranijo v oljih ali inertnih plinih. Vodik s svojim enim samim elektronom živi tudi v skupini 1, vendar plin velja za nemetal.
Zemeljskoalkalijske kovine: Alkalno zemeljske kovine sestavljajo skupino 2 periodične tabele, od berilija (Be) do radija (Ra). Vsak od teh elementov ima dva elektrona v svoji najbolj zunanji energijski ravni, zaradi česar so alkalne zemlje dovolj reaktivne, da jih v naravi le redko najdemo. Niso pa tako reaktivne kot alkalijske kovine. Njihove kemijske reakcije običajno potekajo počasneje in proizvajajo manj toplote v primerjavi z alkalnimi kovinami.
Lanthanidi: Tretja skupina je veliko predolga, da bi se prilegala tretjemu stolpcu, zato je razčlenjena in prevrnjena na stran, da postane zgornja vrsta otoka, ki plava na dnu mize. To so lantanidi, elementi od 57 do 71 - od lantana (La) do lutecija (Lu). Elementi v tej skupini imajo srebrno belo barvo in ob stiku z zrakom porjavijo.
Aktinidi: Aktinidi črtajo spodnjo vrsto otoka in obsegajo elemente 89, aktinij (Ac), do 103, Lawrencium (Lr). Od teh elementov se na Zemlji v naravi v naravi pojavita le torij (Th) in uran (U). Vsi so radioaktivni. Aktinidi in lantanidi skupaj tvorijo skupino, imenovano notranje prehodne kovine.
Prehodne kovine: Če se vrnemo k glavnemu delu tabele, preostale skupine 3 do 12 predstavljajo preostale prehodne kovine. Trdi, a previdni, sijoči in imajo dobro prevodnost, ti elementi so navadno pomislili, ko slišite besedo metal. Tu živijo številni največji hiti kovinskega sveta - tudi zlato, srebro, železo in platina.
Povojne kovine: Pred skokom v nemetalni svet skupne značilnosti niso lepo razdeljene po navpičnih skupinskih črtah. Povojne kovine so aluminij (Al), galij (Ga), indij (In), talij (Tl), kositer (Sn), svinec (Pb) in bizmut (Bi) in obsegajo skupino 13 do skupine 17. Ti elementi imajo nekaj klasičnih lastnosti prehodnih kovin, vendar so ponavadi mehkejši in se obnašajo slabše kot druge prehodne kovine. Številne periodične tabele bodo pod diagonalo, ki povezuje bor z astatinom, podčrtano krepko "stopnišče". Kovine korozije po prehodu segajo spodaj levo od te vrstice.
Metalloidi: Metaloidi so bor (B), silicij (Si), germanij (Ge), arzen (As), antimon (Sb), telur (Te) in polonij (Po). Oblikujejo stopnišče, ki predstavlja postopen prehod iz kovin v nemetale. Ti elementi se včasih obnašajo kot polprevodniki (B, Si, Ge) in ne kot prevodniki. Metalloide imenujemo tudi "polimetali" ali "slabe kovine."
Nemetali: Vse ostalo v zgornjem desnem kotu stopnišča - in poleg tega vodik (H), nasedli nazaj v skupino 1 - je nepomembno. Sem spadajo ogljik (C), dušik (N), fosfor (P), kisik (O), žveplo (S) in selen (Se).
Halogeni: Najboljši štirje elementi skupine 17, od fluora (F) do astatina (At), predstavljajo eno od dveh podskupin nemetalov. Halogeni so precej kemično reaktivni in se ponavadi združijo z alkalijskimi kovinami, da nastanejo različne vrste soli. Namizna sol v vaši kuhinji je na primer porok med natrijevim alkalijskim kovinom in halogenskim klorom.
Plemeniti plini: Brezbarvni, brez vonja in skoraj popolnoma nereaktivni, inertni ali žlahtni plini zaokrožijo mizo v skupini 18. Številni kemiki pričakujejo, da bo te značilnosti delil oganesson, eden od štirih novoimenovanih elementov; ker pa ima ta element razpolovno dobo v milisekundah, ga nihče ni mogel neposredno preizkusiti. Oganesson zaključi sedmo obdobje periodične tabele, tako da, če komu uspe sintetizirati element 119 (in dirka za to že poteka), se bo vrgel okoli osme vrstice v stolpcu alkalnih kovin.
Zaradi cikličnosti, ki jo ustvarja periodičnost, ki tabeli daje ime, nekateri kemiki raje predstavljajo Mendelejevo mizo kot krog.
Dodatno viri: