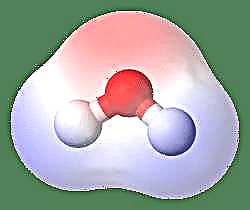
Že dolgo je znano, da imajo vse molekule dva enaka in nasprotna naboja, ki sta ločena z določeno razdaljo. V primeru takih polarnih molekul center negativnega naboja ne sovpada s središčem pozitivnega naboja. Obseg polarnosti v takšnih kovalentnih molekulah lahko opišemo z izrazom Dipolov trenutek, ki je v bistvu merilo polarnosti v polarni kovalentni vezi.
Najpreprostejši primer dipola je molekula vode. Molekula vode je polarna zaradi neenakomerne delitve elektronov v "upognjeni" strukturi. Molekula vode tvori kot, na konicah pa atomi vodika in kisik v zgornjem delu. Ker ima kisik večjo elektronegativnost kot vodik, ima stran molekule z atomom kisika delni negativni naboj, medtem ko ima vodik v središču delni pozitivni naboj. Zaradi tega smer dipolnega momenta kaže na kisik.
V jeziku fizike je električni dipolni moment merilo ločevanja pozitivnih in negativnih električnih nabojev v sistemu nabojev, to je merilo celotne polarnosti polnilnega sistema - to je ločitev električnega naboja molekul, ki vodi v dipol. Matematično in v preprostem primeru dveh točkovnih nabojev, enega z nabojem + q in enega z nabojem? Q, lahko električni dipolni moment p izrazimo kot: p = qd, kjer je d premični vektor, ki kaže od negativnega naboja do pozitivni naboj. Tako vektor električnega dipolnega momenta p kaže od negativnega na pozitivnega naboja.
Drug način pogleda nanjo je predstavljanje Dipolovega trenutka z grško črko m, m = ed, kjer je e električni naboj in d je razdalja ločitve. Izražena je v enotah Debye in zapisana kot D (kjer je 1 Debye = 1 x 10-18e.s.u cm). Dipolni moment je vektorska količina, zato ga predstavlja majhna puščica z repom v pozitivnem središču in glavo, usmerjeno proti negativnemu središču. V primeru molekule vode je trenutek dipola 1,85 D, molekula klorovodikove kisline pa 1,03 D in je lahko predstavljena kot:
Za Space Magazine smo napisali veliko člankov o dipolskem trenutku. Tukaj je članek o tem, iz česa je narejena voda, in tu je članek o molekulah.
Če želite imeti več informacij o dipolskem trenutku, si oglejte te članke iz časopisa Hyperphysics and Science Daily.
Posneli smo tudi celo epizodo Astronomy Cast, vse o molekulah v vesolju. Poslušajte tukaj, Epizoda 116: Molekule v vesolju.
Viri:
http://sl.wikipedia.org/wiki/Electric_dipole_moment
http://sl.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://sl.wikipedia.org/wiki/Water_molecule